Kantasoluhoito hevosen Flexor-jännevammoille
SDFT-vammat hevosissa ja regeneratiivisessa lääketieteessä
Pinnallinen digitaalinen jännejänne (SDFT) -vammat ovat merkittävä lähtökohta surma-urosta ja vähentynyttä urheilullisuutta hevosurheiluteollisuudessa. Kirjoitetun esiintyvyyden ollessa 8 - 43% täysiverisissä kilpahevosissa (Dowling, 2000). Tämä johtuu näiden vammojen suuresta yleisyydestä, pidentyneestä toipumisajasta ja korkeasta toistumisasteesta. SDFT-vammat paranevat hitaasti, kun 20–60% loukkaantuneista rodun hevosista palaa täyteen urheilukykyyn, mutta jopa 80% loukkaantuneista kilpahevosista joutui vaurioitumaan uudelleen (Dowling, 2000). Tämä taipumus parantua hitaasti ja mekaanisesti pienemmän solunulkoisen matriisin rakentaminen johtuu todennäköisesti siitä, että jänteet ovat vähäisemmin verisuonittuneita, läsnä soluissa, joilla on vähentynyt mitoottinen vaikutus ja että kudoksissa on vähän esi-isäntäsoluja. Äskettäiset mesenkymaalisten kantasolujen (MSC) tutkimukset ovat vaikuttaneet mahdollisuuteen kehittää regeneratiivista lääketiedettä mahdollisena uutena hoitona SDFT-vammoille.
Pinnallinen digitaalinen jännejänne (SDFT) on tärkeä lähtökohta säälittävän urheilun teollisuudessa valitetulle urheilullisuudelle ja vähentyneelle urheilullisuudelle. Ohjelman kuvaus esiintyy 8–43 prosentilla täysiverisistä kilpahevosista.
Jänteen rakenne hevosessa
Jänteet koostuvat pääosin vedestä (~ 70%); loput 30% sisältää kollageenia ja kollageenitonta matriisia. Normaalissa flexor-jänteessä tyypin I kollageeni on yleisin. Tyyppejä II, III, IV ja V on myös olemassa, tosin pienemmissä määrin tietyissä jänteen sisällä olevissa paikoissa. Tyyppi II voi sijaita luisissa lisäyksissä ja alueilla, joilla jänne muuttaa suuntaa kattaakseen luisen ulkoneen, ja se on suunniteltu kestämään puristusta ja jännitystä. Tyyppejä III, IV ja V löytyy vain kellarimembraaneista ja endotendoneista. Kollageenimolekyylit on järjestetty mikrofibrilleiksi, alafibrilliksi ja fibrilleiksi, ja ne luokitellaan edelleen soluihin, jotka on jaettu löysästi endotenoniseptojen avulla, ja jäljelle jäävä matriisi koostuu tenosyyteistä ja glykoproteiineista. Solutyypit I, II ja III on tunnistettu hevosen jänteiden soluissa. Näiden solujen allokaatio vaihtelee iän mukaan, ja se voi liittyä suurimmaksi osaksi solunulkoisen matriisin synteesiin. Normaalista SDFT: stä on löydetty useita glykosaminoglykaania, mukaan lukien kondroitinsulfaatti, kerataanisulfaatti, dermataanisulfaatti, hepariini, heparinsulfaatti ja hyaluronihappo. Proteoglykaanikankoriini, fibromoduliini ja biglykaani esiintyvät koko SDFT: ssä ja vaikuttavat tenosyyttitoimintoihin, kollageenin fibrillogeneesiin ja kuitujen mittasuhteisiin. Tämä vaikuttaa jänteen lujuuteen. Proteoglykaanilla on myös potentiaalinen rooli kasvutekijöiden määräämisessä kollageenimatriisiin.
Jänteet koostuvat pääosin vedestä (~ 70%); loput 30% sisältää kollageenia ja kollageenitonta matriisia.
Hevosen yleiset jännevammat
Luonnollisesti esiintyviä jännevammoja kuvataan nimellä "fibrillaarinen venytys, liukuminen ja repiminen, jota seuraa fibrilolyysis", joka liittyy "entsyymien vapautumiseen vaurioituneista fibroblasteista ja tulehduksellisista soluista" (Dowling, 2000). Juuri siellä alkaa paranemisprosessi, jota seuraa tulehduksen, leviämisen, uudelleenmuodostumisen ja kypsymisen päävaiheet. Tyypin III kollageeni on ensimmäinen, joka integroituu vauriokohtaan, muodostaen fibrillaariset ristisidokset, jotka antavat varhaisen lujuuden ja stabiilisuuden vauriokohdassa. Lisääntyneet määrät tyyppejä IV ja tyyppiä V kollageenia kehittyvät sitten pian. Näiden akuuttien vaiheiden jälkeen tyypin I kollageenikuitut käyvät ilmeisimmin ja vapaita tyypin I ja tyypin III kollageenifibrillejä esiintyy hieman pienemmissä määrin noin 6 kuukauteen vahingon jälkeen. Myöhemmin tyypin I kollageenifibrillit hallitsevat jälleen, mikä osoittaa parantavan kudoksen jatkuvaa uudistumista ja normalisoitumista. Tyypin III kollageenin epänormaalit korkeat tasot ja suoraviivaisen kokoonpanon puuttuminen voi esiintyä jopa neljätoista kuukautta vamman jälkeen. Kuitumaisessa arpikudoksessa matriisin, jolla on vielä huonompi biomekaniikka verrattuna keskimäärin jännekudokseen, epänormaalin järjestelyn ja koostumuksen sekä vähentyneen paranemisnopeuden ajatellaan olevan syynä SDFT: n kohonnut uusi vahinko. Lisätietoja hevosen jänteistä ja tavallisista jännevammoista (paitsi tukehtumisvaurioita) suosittelen viittaamaan Howell Equine -käsikirja jänne- ja nivelvaurioista.
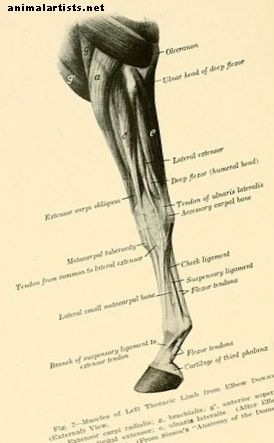
Luonnollisesti esiintyviä jännevammoja kuvataan nimellä "fibrillaarinen venytys, liukuminen ja repiminen, jota seuraa fibrilolyysis", joka liittyy "entsyymien vapautumiseen vaurioituneista fibroblasteista ja tulehduksellisista soluista".
Hevoslääketieteen nykyiset terapiavaihtoehdot
SDFT-vammojen hoitamiseksi on tällä hetkellä useita hyväksyttyjä vaihtoehtoja. Nämä terapiavaihtoehdot voidaan luokitella fysikaalisiin, farmakologisiin, kirurgisiin terapioihin. Fysikaalisia hoitomuotoja esiintyy jäätymisen, kylmävesiterapian, paineen sitomisen ja pysähtymisen muodossa, ja niitä on pidetty kulmakivenä SDFT-vammahoidon alkuvaiheissa tulehduksen vähentämiseksi ja lisävaurioiden mahdollisuuden vähentämiseksi. Fysikaalisia terapioita käytetään usein yhdessä lääkehoitojen kanssa. Lääkehoito-ohjelmiin kuuluvat yleensä tulehduskipulääkkeet, natriumhyaluronaatti, polysulfatoidut glykosaminoglykaanit ja beetaminopropionitriilifumaraatti. Korjaaviin kirurgisiin vaihtoehtoihin sisältyy tällä hetkellä lisä ligamentt desmotomia, perkutaaninen jänteen halkaisu, synteettiset jänneimplantit ja vasta-ärsytys. Muita, vähemmän tutkittuja terapiavaihtoehtoja ovat terapeuttinen matalan intensiteetin ultraääni, matalataajuinen infrapunalaserhoito ja sähkömagneettinen kenttähoito. Tällaisten hoitomuotojen tulokset ovat olleet monipuolisia, koska on ollut vähäistä todistettavissa olevaa tietoa siitä, että jollakin edellä mainituista hoitomuodoista on ollut jatkuvasti luotettavia tai pitkäaikaisia etuja. Tämä johtuu todennäköisesti osittain hoitotekniikoiden ja mieltymysten suuresta vaihtelusta eläinlääkäreiden ja omistajien keskuudessa.
Fysikaalisia hoitomuotoja esiintyy jäätymisen, kylmävesiterapian, paineen sitomisen ja pysähtymisen muodossa, ja niitä on pidetty kulmakivenä SDFT-vammahoidon alkuvaiheissa tulehduksen vähentämiseksi ja lisävaurioiden mahdollisuuden vähentämiseksi.
Mesenkymaalisten kantasolujen (MSC) hoito hevosen lääketieteessä
Mesenkymaaliset kantasolut ovat ei-hematopoieettisia monikomponenttisia kantasoluja, joilla on merkitystä hevosten ortopedisten vammojen hoidossa. Kantasolut luokitellaan joko alkion tai aikuisen soluiksi luovuttajan kehitystasosta riippuen. Tätä tutkimusta varten keskitytään tässä aikuisten soluihin. Aikuisten kantasolut ovat normaalisti asuva solukannat, joita löytyy kustakin kudostyypistä, ja ne auttavat tarjoamaan asianmukaisen elimen muodon kaikissa säännöllisissä solujen vaihtomenetelmissä. Näillä kantasoluilla on myös kyky eritellä tarvittaessa muihin solutyyppeihin erilaisista kudosperäisistä lähteistä, mitä kutsutaan solujen plastilisuudeksi. MSC: ien käyttöä kudosten uudistamisessa edistettiin ensin tämän idean perusteella solujen plastilisuudesta; vaurioituneita kudoksia stimuloidaan suoraan MSC: n injektiolla, solut asuttavat vauriokohdan, eriytyvät kyseiselle kudokselle sopivaan solutyyppiin ja regeneraatio alkaa. Myöhemmin havaittiin, että nämä solut stimuloivat myös uudistumista epäsuorasti tuottamalla bioaktiivisia troofisia ja immunomodulaarisia tekijöitä.
Rasvakudos ja luuydin ovat hevosen lääketieteessä käytettäviä MSC-yhdisteiden kahta tavanomaisinta lähdettä, vaikka lähteet, kuten perifeerinen veri ja napanuoran veri, ovat kasvussa, koska ne ovat vähemmän invasiivisia. Verrattuna ihmisen MSC: ihin, eläinperäisistä MSC: istä ei ole tällä hetkellä saatavissa karakterisointistandardeja. Siksi eri yritykset käyttävät erilaisia menetelmiä eläinten MSC: n karakterisoimiseksi, mikä tekee vaikeaksi vertailla hevosissa käytetyn MSC-hoidon tutkimustuloksia ja kliinisiä tuloksia. Vaikka eläimistä saatavat MSC: t voidaan luokitella niiden kyvyn mukaan tarttua muoviin ja erottua, niiden pinta-antigeeniekspressiota ei vieläkään ole helppo tunnistaa. Tämä spesifisten vasta-aineiden rajoitettu saatavuus eläinlääketieteessä rajoittaa MSC: ien todellisen immunofenotyypin määrittämisen mahdollisuuksia.
Tulokset nykyisistä MSC-tutkimuksista
Vuonna 2003 määriteltiin ensin MSC: ien käyttö hevosen jänteiden vammojen hoidossa, ja aiheesta julkaistiin vain viisi tutkimusartikkelia (Van de Walle, 2016). Tuon tapahtuman jälkeen MSC: ien käyttö hevosen uudistavassa lääketieteessä on noussut nopeasti, ja tuhansia hevosia hoidetaan tällä menetelmällä. Hevosen MSC-terapioiden tehokkuus on kuitenkin edelleen jonkin verran epävarma, koska sopivia kontrolliryhmiä ei aina käytetä, ja muita biologisia tekijöitä käytetään usein kantasolujen yhteydessä. Silti aikaisemmat tutkimukset ovat osoittaneet positiivisen suhteen mesenkymaalisten kantasolujen hoidon ja jänteiden terveen uudistumisen välillä SDFT-vammoissa, joissakin osoitettu vähentyneiden uudelleenvaurioiden määrää (Badial, 2013; Carvalho, 2011; Godwin, 2013; Guercio, 2015; Smith, 2003).
Erityisesti vuoden 2013 tutkimuksessa käytettiin samanlaisia menetelmiä kuin tässä tutkimuksessa. Tässä aikaisemmassa tutkimuksessa leesiot indusoitiin käyttämällä kollagenaasigeelinjektiota kahdeksan sekarotuisen hevosen SDFT: n metakarpal-alueella. Hoitoryhmän hevosia käsiteltiin mesenkymaalisten kantasolujen interlesionaalisella injektiolla, joka oli johdettu verihiutalekonsentraattiin suspendoidusta rasvakudoksesta. 16 viikon hoidon jälkeen suoritettiin biopsiat histopatologisia, immunohistokemiallisia ja geeniekspressioanalyysejä varten. Tämän tutkimuksen tulokset osoittivat, että mesenkymaalisten kantasolujen ja verihiutalekonsentraatin käyttö esti jänneleesioiden etenemisen, johti parempaan solujen järjestelyyn ja vähentää tulehdusta verrattuna kontrolliryhmään. (Badial, 2013)
Vuoden 2014 tutkimuksessa, jossa oli yhdeksän hevosta, joilla oli aiemmin SDFT-vammoja, havaittiin todisteita korjaavista kudosprosesseista hoidon jälkeen, kun hoitomenetelmänä käytettiin rasvaperäisiä mesenkymaalisia kantasoluja (Guercio, 2014). Kaksivuotisessa tutkimuksessa, joka koski 141 asiakkaan omistamaa kilpahevosta, joilla oli jo olemassa olevia vammoja, käytettiin luuytimestä peräisin olevia kantasoluja rasvaperäisten solujen sijasta, mutta hoidossa ei havaittu haitallisia vaikutuksia. kuitenkin kilpahevosten keskuudessa havaittiin merkittävää laskua uudelleenvaurioissa (Godwin, 2012).
Vaikka nämä aiemmat tutkimukset ovat kaikki yrittäneet havaita suhdetta SDFT-vammojen ja mesenkymaalisten kantasolujen välillä, tässä tutkimuksessa on monia hämmentäviä tekijöitä ja monia ilmeisiä aukkoja. Joissakin tutkimuksissa ei käytetty riittävää määrää kohteita vakuuttavan todisteen antamiseen, toisissa tutkimuksissa käytettiin laajaa valikoimaa rotuja, ikä-, sukupuoli- ja urheilutauteita. Toiset käyttävät vaihtelevaa määrää kantasoluja ja hoitojaksoja. Ehkä suurin hämmentävä tekijä on se, että suurimmassa osassa näitä tutkimuksia käytettiin hevosia, joilla oli jo olemassa olevia vammoja, mikä aiheutti suuria eroja vamman koosta, vakavuudesta, kestosta jne., Eikä pystynyt selvittämään, oliko näillä tekijöillä suhdetta tuloksiin. Käyttämällä suurempaa ryhmää ikää, sukupuolta, rodua ja kurinpitomenetelmiä rajoittavia hevosia, ennalta asetettua määrää kantasoluja, tiettyä vammaa, hoitosuunnitelmaa ja hoitojaksoa ja pyrkimällä luomaan suhteita näiden tekijöiden ja tulosten välille, uusien tutkimusten tulisi pyrkiä vähentämään hämmentäviä tekijöitä ja hankkimaan vakuuttavampaa näyttöä. Tästä ajasta lähtien tarvitaan lisätutkimuksia hevoseläinten kantasoluhoitovaikutusten tutkimiseksi.
SDFT-vammat ja MSC-tietokilpailu
Katso tietokilpailutilastotViitteet
Badial, P., Deffune, E., Borges, A., Carvalho, A., Yamada, A., Álvarez, L., Garcia Alves, A. (2013). Hevosen jännetulehdushoito mesenkymaalisilla kantasoluilla ja verihiutalekonsentraateilla: satunnaistettu kontrolloitu tutkimus. Kantasolujen tutkimus ja hoito, 4 (4), 1-13. doi: 10.1186 / scrt236
Crovace, A., Lacitignola, L., Rossi, G., Francioso, E. (2009). Autologisten viljeltyjen luuytimen mesenkymaalisten kantasolujen ja luuytimen mononukleoitujen solujen histologinen ja immunohistokemiallinen arviointi hevosen pinnallisen digitaalisen flexor-jänteen kollagenaasi-indusoidussa tendiniitissä. Veterinary Medicine International, 2010, 1-10. doi: 10, 4061 / 2010/25097
Dowling, BA, Dart, AJ, Hodgson, DR ja Smith, RKW (2000), Hevosen pinnallinen digitaalinen flexor-tendoniitti. Equine Veterinary Journal, 32: 369–378. doi: 10, 2746 / 042516400777591138
Godwin, EE, Young, NJ, Dudhia, J., Beamish, IC ja Smith, RKW (2012). Luuytimestä johdettujen mesenkymaalisten kantasolujen implantointi osoittaa parantuneen lopputuloksen hevosilla, joilla on pinta-alaisen digitaalisen flexor-jänteen ylikuormitusvaurio. Equine Veterinary Journal, 44 (1): 25–32. doi: 10.1111 / j.2042-3306.2011.00363.x
Guercio, A., Di Marco, P., Casella, S., Russotto, L., Puglisi, F., Majolino, C., Piccione, G. (2015). Mesenkymaaliset kantasolut, jotka on johdettu subkutaanisesta rasvasta ja verihiutaleista rikkaasta plasmasta, jota käytetään urheilullisissa hevosissa ja pintaisen digitaalisen flexor-jänteen sääli. Journal of Equine Veterinary Science, 35 (1), 19 - 26. doi: 10, 1016 / j.jevs.2014.10.006
Richardson LE, Dudhia J., Clegg PD, Smith, R. (2007). Kantasolut eläinlääketieteessä - yritykset hevosen jänteen uudistamiseksi vamman jälkeen. Trends in Biotechnology, 25 (9), 409-16.
Van de Walle, G., De Schauwer, C., Fortier, L. (2016). Mesenkymaalinen kantasoluhoito. Hevosen kliininen immunologia (1. painos) John Wiley & Sons, Inc. Haettu osoitteesta https://lmunet.illiad.oclc.org/illiad/TNF/illiad.dll?Action=10&Form=75&Value=25484